| |
Конкурс научных работ 2015 года
Фундаментальные и прикладные аспекты химии активированных ацетиленов.
Новая реакция в химии ацетиленов – полный разрыв С≡С-связи под действием амина
С.Ф. Василевский, М.П. Давыдова, А.И. Говди, А.А. Степанов
1. Общая формулировка научной проблемы и ее актуальность.
Поиск корреляций структура-свойства, которые расширяют наши знания о взаимосвязи между строением соединения и его реакционной способностью или биологической активностью, традиционно является актуальным и одним из центральных направлений в современной органической химии.
В цикле работ представлены фундаментальные и прикладные аспекты в химии активированных ацетиленов. К первому относится углубленное изучение закономерностей и особенностей и механизмы недавно открытых в нашей группе новых каскадных реакций активированных ацетилениларенов с азотистыми нуклеофилами, в том числе, мягкого расщепления тройной связи на расширенном круге ацетилениларенов: R-арил-α-кето-R’-ацетиленов (1) [1], 1- и 2-R-ацетиленил-9,10-антрахинонов (2) [2,3].
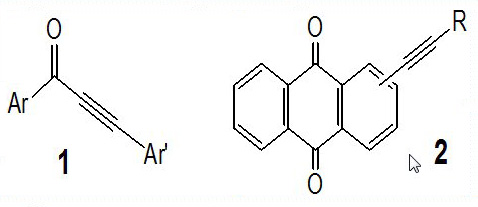
Прикладное направление отражено в результатах поиска возможных лекарственных средств путем модификации природных соединений (комбретастатин (CA-4) [4], лаппаконитин (LPC) [5], бетулоновая кислота (BA) [6,7]) введением ацетиленовых остатков и дальнейшей трансформацией.
2. Конкретная решаемая в работе задача и ее значение.
Первой конкретной решаемой задачей работы является изучение закономерностей новых каскадных межмолекулярных реакций присоединения аминов (общности и особенности, регио- и стереонаправленность, механизмы) в ряду R-арил-α-кето-R’-ацетиленов (1).
При изучении внутримолекулярных реакций циклизации диазониевых солей 2-R-ацетиленил-9,10-антрахинонов (2) возникает вопрос о возможности селективной регионаправленности, т.к. процесс может происходить как по 5-exo-dig-, так и по 6-endo-dig-пути.
При проведении скрининга (совместно с НИОХ СО РАН) синтезированных аналогов, близких к природным соединениям, решался вопрос о выявлении корреляции структура – биологическая активность, что являются важным условием при выборе структур в поисках их возможного применения качестве лекарственных средств.
3. Используемый подход, его новизна и оригинальность.
Особенностью нашего подхода является выбор системы, сочетающей наличие в субстрате карбонильной акцепторной группы, сближенной и одновременно сопряженной с тройной связью молекулы (α-ацетиленовый кетон и пери-ацетиленил-9,10-антрахиноны). Для таких систем можно ожидать повышенный отклик на воздействие как внутренних, так и внешних факторов (структура соединений, условия реакции). Сочетание такой сопряженной системы с направленным варьированием структуры реагентов и функциональных групп и учетом важности температурного режима, привело к открытию новых реакций [1], неожиданных перегруппировок [2].
4. Полученные результаты и их значимость.
Получение аналогов комбретастатина реакцией Михаэля [4] показало, что присоединение аминов к кетоацетилену (1) ведет преимущественно к E-изомерам (3). Неожиданный результат был получен при проведении этой же реакции с этилендиамином. Показано, что наряду с ожидаемым продуктом Михаэля, происходит разрыв прочной тройной связи с образованием метиларилкетона (5) и 2-замещенного имидазолина (6). Предложен механизм реакции [1]. Этот важный фундаментальный результат будет способствовать углубленному пониманию реакционной способности соединений с тройными связями, поскольку известно, что тройная связь одна из наиболее прочных, но в достаточно мягких условиях (действие амина) С≡С-связь подвергается полному разрыву [1]. Такие реакции не были известны.
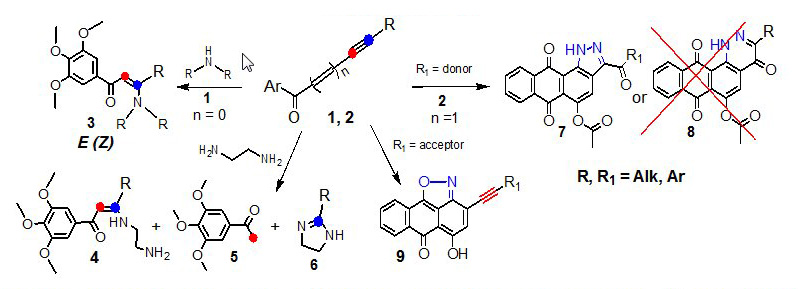
При циклизации диазониевых солей 2-R-ацетиленил-9,10-антрахинонов (2) возможны два альтернативных пути – образование как 5-, так и 6-членного циклов. Нами показано, что процесс идет региоселективно – образуется только 5-exo-dig-продукт (7). Другой важной особенностью этой реакции является высокая чувствительность к природе ацетиленового заместителя. При наличии донорных заместителей вместо пиразольного формируется изоксазольный цикл [2,3]. Для количественной оценки двойственной реакционной способности этих соединений были привлечены квантово-химические расчеты (совместно с Prof. I.V.Alabugin, USA) [2].
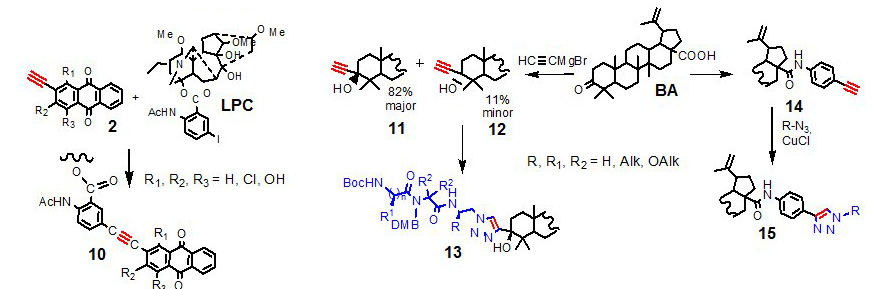
Известно, что ацетилены являются перспективными фармакофорами. С учетом этого факта и высокой реакционной способности ацетиленов, они были использованы для модификации природных растительных метаболитов. На их основе получены новые биоконьюгаты: ацетиленилантрахинон-лаппаконитин (10) и ацетилен-бетулоновая кислота (11,12,14). Алкины (11 и 12) были дополнительно трансформированы в биогибрид пептиды-бетулоновая кислота (13), а ацетилен (14) – в триазол-бетулоновая кислота (15).
Скрининг синтезированных гетероциклов (совместно с НИОХ СО РАН) показал, что производные СА-4 и ВА проявляют высокий противовоспалительный эффект, сопоставимый или превышающий активность референсного соединения (индаметацина). Нахождение корреляции структура–биологическая активность - важный результат при поиске перспективных агентов в ряду указанных выше тритерпеноидов и алкалоидов.
С фундаментальной точки зрения открытие новой реакции расщепления тройной связи, ее механизма, а также выявление закономерностей региоселективного направления циклизации диазониевых солей ацетиленилантрахинонов - это важные результаты, которые пополнят фундаментально значимые правила Болдвина (K. Gilmore, I. V. Alabugin, Chem. Rev. 2011, 111, 6513), объясняющие принципы направления циклизации при наличии альтернативных путей.
5. Уровень полученных результатов в сравнении с мировым.
Наши работы по исследованию закономерностей реакций внутри- и межмолекулярного присоединения функции по тройной связи в ряде случаев имеют пионерский характер и хорошо известны российским и зарубежным ученым. Мировой уровень наших исследований в этой области подтверждается независимой внешней экспертизой – публикацией статей в ведущих отечественных и зарубежных журналах, поддержкой восьмью грантами: РФФИ (3), РАН (2), СО РАН (2), Минобрнауки, наличием Приглашенных докладов (см. списки публикаций, грантов, конференций).
6. Вклад авторского коллектива.
Вклад авторского коллектива составляет 80%.
Список публикаций.
- S. Roy, M.P. Davydova, R. Pal, K. Gilmore, G.A. Tolstikov, S.F. Vasilevsky, I. V. Alabugin. Dissecting Alkynes: Full Cleavage of Polarized C≡C Moiety via Sequential Bis-Michael Addition/Retro-Mannich Cascade. J. Org. Chem., 2011, 76 (18), 7482–7490.
- A.A. Stepanov, L.M. Gornostaev, S.F. Vasilevsky, E.V. Arnold, V.I. Mamatyuk, D.S. Fadeev, B. Gold, I.V. Alabugin. Chameleonic Reactivity of Vicinal Diazonium Salt of Acetylenyl-9,10-anthraquinones: Synthetic Application toward Two Heterocyclic Targets. J. Org. Chem., 2011, 76 (21), 8737-8748.
- С.Ф. Василевский, А.А. Степанов, Д.С. Фадеев. Двойственная реакционная способность диазониевых солей, образуемых 1-амино-2-ацетиленил-9,10-антрахинонами. Изв.АН, Сер.хим,. 2012, №11, 2071-2078.
- M.P. Davydova, I.V. Sorokina, T.G. Tolstikova, V.I. Mamatyuk, D.S. Fadeev, S.F. Vasilevsky. Synthesis of New Combretastatin A-4 Analogues and Study of Their Anti-Inflammatory Activity. Russian Journal of Bioorganic Chemistry, 2015, 41 (1), 70–76.
- А.А.Степанов, С.Ф.Василевский, Г.А.Толстиков, Этинилирование лаппаконитина как путь модификации алкалоидов. Химия в интересах устойчивого развития. 2010, №8, 505-510.
- S.F. Vasilevsky, A.I. Govdi, I.V. Sorokina, T.G. Tolstikova, G.A. Tolstikov, V.I. Mamatuyk, I.V. Alabugin. Rapid Access to New Bioconjugates of Betulonic Acid via Click Chemistry. Bioorg. Med. Chem. Lett., 2011, 21, 62-65.
- A.I. Govdi, N.V. Sokolova, I.V. Sorokina, D.S. Baev, T.G. Tolstikova, V.I. Mamatyuk, D.S. Fadeev, S.F. Vasilevsky, V.G. Nenajdenko. Synthesis of new betulinic acid–peptide conjugates and in vivo and in silico studies of the influence of peptide moieties on the triterpenoid core activity. Med. Chem. Commun., 2015, 6, 230-238.
- S.F. Vasilevsky, A.I. Govdi, T.G. Tolstikova, G.A. Tolstikov. Synthesis and Pharmacological Properties of New Family of the Betulonic acid - Acetylene Bioconjugates. II Intern. Symposium on Drug Discovery, Araraquara, San Paulo, 27th - 29th July, 2011, (Invited Report).
- S.F. Vasilevsky, A.I. Govdi, G.A. Tolstikov. Click Chemistry is Convenient Tool for Preparing of Biological Active New Bioconjugates - Betulonic acid – Heterocycles. BITs 2nd Annual Intern. Conference of Мedchem, Beijing, China, 8-10 August, 2011, (Invited Report).
- S.F. Vasilevsky, A.I. Govdi, T.G. Tolstikova, I.V Sorokina, G.A. Tolstikov. Trends and Perspectives in Searching of New Drugs by Modification of Triterpenoids of the Lupane Family. 4th Annual Russian-Korean Conference “Current Issues of Natural Products Chemistry and Biotechnology”, Novosibirsk, Russia, September 18-21, 2012 (Plenary Report).
- S.F. Vasilevskiy, A.I. Govdi, T.G. Tolstikova, I.V. Sorokina, V. G. Nenaidenko. Green Approach to Synthesis of New Family of Heterocyclic Betulonic Derivatives and their Pharmacological Study. 4th Intern. Annual Congress of Medichem-2013, Hainan, China, November 13-16, 2013.
- S.F. Vasilevskiy, M.P. Davydova. New Reactions of Acetylenes: An Unexpected Easy Full Cleavage of Polarized C≡C Moiety under Action of N-Nucleophiles, 1st Intern. Turkic World Conference on Chemical Sciences and Technologies 27 October - 01 November 2015, Bosnia and Herzegovina (Sarajevo) (Invited Report).
- С.Ф. Василевский, М.П. Давыдова, Б.А. Трофимов. Особенности каскадного распада поляризованной тройной связи в алкинилкетонах под действием полинуклеофилов. «Кластер конференций по органической химии «ОргХим-2013», 17-21 июня 2013, г. Санкт-Петербург, (Приглашённый доклад).
- С.Ф. Василевский, А.И. Говди, Т.Г. Толстикова, И.В. Сорокина, В.Г. Ненайденко. Синтез нового семейства конъюгатов: Бетулоновая кислота - Ацетилены. Модификация и изучение фармакологических свойств. Междисциплинарный Симпозиум по Медицинской, Органической и Биологической Химии, Крым, Новый Свет 25-28 мая 2014, (Пленарный доклад).
Гранты РФФИ:
07-03-00048-а (2007-2009)
10-03-00257-а (2010-2012)
13-03-00129-а (2013-2015).
Гранты ОХНМ РАН:
1. 5.9.3. (2009-2011), коорд. акад. Зефиров Н.С.
2. 5.9.3. (2012-2014), коорд. акад. Зефиров Н.С.
Интеграционные гранты СО РАН:
№93. (2009-2011), коорд. акад. Толстиков Г.А.
№41. (2012-2014), коорд. проф. Салахутдинов Н.Ф.
Во всех выше перечисленных грантах проф. Василевский С.Ф. является непосредственным руководителем.
Грант Минобрнауки РФ.
(2014-2016) Рук. В.Ф. Плюснин, Исполнители - Василевский С.Ф., Степанов А.А.
Адреса авторов из сторонних организаций (в виде примечаний к списку авторов)
- Д.С. Баев - Новосибирский институт органической химии им. Н.Н. Ворожцова Сибирского отделения Российской академии наук, Российская Федерация, 630090 Новосибирск, просп. Акад. Лаврентьева, 9.
- И.В. Сорокина - Новосибирский институт органической химии им. Н.Н. Ворожцова Сибирского отделения Российской академии наук, Российская Федерация, 630090 Новосибирск, просп. Акад. Лаврентьева, 9.
- Т.Г. Толстикова - Новосибирский институт органической химии им. Н.Н. Ворожцова Сибирского отделения Российской академии наук, Российская Федерация, 630090 Новосибирск, просп. Акад. Лаврентьева, 9.
- Г.А. Толстиков - Новосибирский институт органической химии им. Н.Н. Ворожцова Сибирского отделения Российской академии наук, Российская Федерация, 630090 Новосибирск, просп. Акад. Лаврентьева, 9.
- В.И. Маматюк - Новосибирский институт органической химии им. Н.Н. Ворожцова Сибирского отделения Российской академии наук, Российская Федерация, 630090 Новосибирск, просп. Акад. Лаврентьева, 9.
- Д.С. Фадеев - Новосибирский институт органической химии им. Н.Н. Ворожцова Сибирского отделения Российской академии наук, Российская Федерация, 630090 Новосибирск, просп. Акад. Лаврентьева, 9.
- Л.М. Горностаев – Красноярский Государственный Педагогический Университет им. В.П. Астафьева, факультет биологии, географии и химии, Российская Федерация, 660049 Красноярск, ул. Ады Лебедевой, 89
- Е.В. Арнольд – Красноярский Государственный Педагогический Университет им. В.П. Астафьева, факультет биологии, географии и химии, Российская Федерация, 660049 Красноярск, ул. Ады Лебедевой, 89
- И.В. Алабугин – Department of Chemistry and Biochemistry, Florida State University, Tallahassee, Florida 32306
- B. Gold – Department of Chemistry and Biochemistry, Florida State University, Tallahassee, Florida 32306
- S. Roy – Department of Chemistry and Biochemistry, Florida State University, Tallahassee, Florida 32306
- R. Pal – Department of Chemistry and Biochemistry, Florida State University, Tallahassee, Florida 32306
- K. Gilmore – Department of Chemistry and Biochemistry, Florida State University, Tallahassee, Florida 32306
- Н.В. Соколова - Московский Государственный Университет им. М.В. Ломоносова, Химический факультет, Российская Федерация, 119992 Москва, Ленинские горы, 1
- В.Г. Ненайденко - Московский Государственный Университет им. М.В. Ломоносова, Химический факультет, Российская Федерация, 119992 Москва, Ленинские горы, 1
|
| |