Изучение взаимодействия с протеином парамагнитных
интермедиатов, участвующих в реакциях сопряженного переноса электронов
и протонов в bc1 комплексе, методом импульсного ЭПР.
Р.И. Самойлова, С.А. Диканов, (ИХКиГ
СОРАН),
А.Р. Крофтс, Д. Колинг, Т. Холанд В.П. Шинкарев, Э.А. Бэрри
(Центр Биофизики и Компьютерной Биологии Университета
Иллинойс в Урбана-Шампень),
Тошио Ивасаки, Асако Кюносу
(Факультет Биохимии и молекулярной Биологии, Медицинская
школа Ниппон, Токио Япония),
Такетоши Узава (Отделение Естественных Наук в
Университет Осака Коку),
А.Б. Шубин (Институт Катализа им. Борескова СОРАН)
Представленные работы выполнены в течение последних трех лет
и посвящены использованию импульсной ЭПР спектроскопии для изучения промежуточных
парамагнитных состояний убихинона (UQ) и Риске (Rieske) кластера в двух
каталитических центрах bc1 комплекса. Цель работы - обнаружение
специфического взаимодействия с протеином, влияющее на свойства хинона
и Риске кластера и регулирующее каталитическую активность фермента. Работы
выполнены в сотрудничестве с Лабораториями Факультета Биохимии Университета
штата Иллинойс в Урбана-Шампень, Факультета Биохимии Токийского Университета
и Факультета Естественных наук Университета г. Осака. Биохимические и молекулярно
генетические работы по выделению ферментов, их очистке, инкорпорированию
изотопных меток проведены нашими коллегами и поддержаны грантами NIH, NSF
и Japan MEXT. FIRCA грант (Foggarty International Center NIH) и NATO были
сфокусированы на поддержке работ по импульсной спектроскопии ЭПР для российских
участников.
Мультиферментный bc1 комплекс (убихинол : цитохром
с-оксидоредуктаза) катализирует перенос электрона от восстановленного убихинона
(фактически от убихинола) к цитохрому b и с. Предполагается, что убихинон
окисляется в двух последовательных реакциях, которые осуществляются в так
называемых центрах Qi и Qо, локализованных на противоположных
сторонах мембраны. В состав комплекса входят следующие кофакторы (не белковые
молекулы): цитохромы b (две формы, b566 и b562, отличающиеся
спектрами поглощения, ЭПР сигналами и редокс-потенциалами), цитохром c,
железосерный кластер Риске [2Fe-2S] и убихиноны.
Первые две работы [1,2] представляют результаты по исследованию
радикала убихинона в востановительном Qi центре bc1
комплекса, выделенного из Rhodobacter sphaeroides. Частотный анализ
модуляции в спаде сигнала ЭСЭ и анализ двумерных HYSCORE спектров радикала
семихинона указывает на присутствие ядер азота в лигандном окружении.
Электрон-ядерное взаимодействие с характерной константой ~0.8 MHz обусловлено
образованием водородной связи между радикалом убихинона и имидазолиновым
азотом His-217, находящемся на расстоянии 2.5-3.1 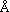 от карбонильной С-О группы хинона. Этому подвижному лиганду отводится важная
динамическая роль в переносе протона в этом месте. Используя дейтерозамещение,
удалось выявить три обменивающихся группы протонов вблизи радикала убихинона,
стабилизированного в Qi центре, отличающихся величиной изотропной
и анизотропной частей константы СТВ. Величины констант свидетельствуют
о принадлежности их водородно связанным протонам из ближайшего протеинового
окружения. В отличие от водородных связей, анализированных ранее в модельных
экспериментах, для радикала, стабилизированного в замороженных растворах,
протеиновые водородные связи значительно выходят из плоскости ароматического
кольца молекулы убихинона. Используя имеющиеся кристаллографические данные,
две группы протонов отнесены к боковым цепям His-217 и Asp-252 а третья,
с маленькой величиной константы СТВ, обусловлена водородной связью кислорода
метокси-групп с водой или близлежащим Asn-221. Эта сетка из водородных
связей удерживает радикал убихинона в соотвтствующей ориентации для эффективного
переноса электрона и протона. На основе этих данных была предложена механистическая
модель Qi центра.
от карбонильной С-О группы хинона. Этому подвижному лиганду отводится важная
динамическая роль в переносе протона в этом месте. Используя дейтерозамещение,
удалось выявить три обменивающихся группы протонов вблизи радикала убихинона,
стабилизированного в Qi центре, отличающихся величиной изотропной
и анизотропной частей константы СТВ. Величины констант свидетельствуют
о принадлежности их водородно связанным протонам из ближайшего протеинового
окружения. В отличие от водородных связей, анализированных ранее в модельных
экспериментах, для радикала, стабилизированного в замороженных растворах,
протеиновые водородные связи значительно выходят из плоскости ароматического
кольца молекулы убихинона. Используя имеющиеся кристаллографические данные,
две группы протонов отнесены к боковым цепям His-217 и Asp-252 а третья,
с маленькой величиной константы СТВ, обусловлена водородной связью кислорода
метокси-групп с водой или близлежащим Asn-221. Эта сетка из водородных
связей удерживает радикал убихинона в соотвтствующей ориентации для эффективного
переноса электрона и протона. На основе этих данных была предложена механистическая
модель Qi центра.
В работах [3,4] изучалось взаимодействие Риске кластера с субстратом,
находящемся в окислительном Qo-центре bc1 комплекса из Rhodobacter
sphaeroides. Ориентация кластера и образование комплекса между железосерным
белком и субстратом является лимитирующей стадией реакции переноса электрона
на окислительном центре. Достоверно установлено, что редокс свойства и
параметры g-тензора в спектрах ЭПР Риске кластера меняются в зависимости
от того, какое вещество находится в Qо центре, который в нативном
белке свободен или занят убихиноном. Наиболее широко используемыми субстратами,
замещающими убихинон в Qо центре, являются два лекарственных
препарата, стигмателин и миксотиазол. Предполагается, что стигмателин,
также как и убихинон, образует водородную связь через карбонильный фрагмент
с Ne азотом гистидиновых лигандов
Риске кластера, удерживая его в ориентации наиболее эффективной для электронного
переноса. При этом спиновая плотность и константа на Nb
азоте гистидина зависит от прочности и направленности водородной связи
между Ne азотом и молекулой субстрата.
Используя ESEEM, в работе [3] проведен анализ сверхтонкого взаимодействия
ядер азота 14Nb для убихинона,
стигмателина или миксотиазола в Qо центре. Обнаружено существенное
отличие величины изотропной константы СТВ и параметров квадрупольного взаимодействия
на азоте Nb гистидина в присутствии
миксотиазола по сравнению с убихиноном и стигмателином. Эта разница объяснена
наличием или отсутствием водородной связи между гистидином Риске и субстратом.
В двух последних работах [5,6] ЭСЭ спектроскопия применена
для анализа структурных факторов, влияющих на окислительные свойства Риске
кластера в двух протеинах, выделеных из гипертермофильных архебактерий
и отличающихся редокс потенциалами. Протеин с потенциалом ~ +190 mV, (high-potential
sulfredoxin или SDX) выделен из бактерий Sulfolobus Tokadaii, с
потенциалом ~ -90 mV (low-potential arhaeal feredoxin или ARF) выделен
из Sulfolobus solfotaricus. 14N ЕSEEM и HYSCORE спектры
существенно отличны для SDX и ARF из-за отличий в координационной геометрии
гистидиновых лигандов Риске. Впервые показано, что параметры тензора квадрупольного
взаимодействия ядер азота гистидина более чувствительны к изменению геометрии
лигандов чем параметры тензора СТВ. Эта особенность может быть использована
для сравнительной характеристики Риске кластеров в различных бактериях
и мутантах.
В работе [6], с использованием изотопного замещения на 15N
в Риске кластере SDX, впервые получены доказательства участия в водородной
связи двух обменивающихся ядер азота,: Ne
азот гистидина и пептидного 15Np азота.
Экспериментальная часть работы по ЭСЭ спектроскопии выполнена
на спектрометре фирмы Брукер в Университете штата Иллинойс в Урбана-Шампень,
в связи с необходимостью использования жидкого гелия для регистрации сигнала
в образцах bc1 комплекса. Обработка данных проводилась в Новосибирске
и в Урбана-Шампень.
1. D.R.J. Kolling, R.I. Samoilova, J.T. Holland, E.A. Berry,
S.A. Dikanov and A.R. Crofts
Exploration of Ligands to the Qi site
Semiquinone in the bc1 Complex Using High-resolution EPR. Journ.
Biol. Chem. 2003, V. 278, p 39747-39754
2. S.A. Dikanov, R.I. Samoilova, D.R.J. Kolling, J.T. Holland
and A.R. Crofts
Hydrogen Bonds Involved in Binding the Qi
–site Semiquinone in the bc1 Complex, Identified through Deuterium
Exchange Using Pulse EPR. Journ. Biol. Chem. 2004, V. 279, p 15814-15823.
3. R.I. Samoilova, D.R.J. Kolling, Taketoshi Uzawa, Toshio
Iwasaki, A.R. Crofts and S.A. Dikanov.
The interaction of Rieske Iron-Sulfur Protein with
Occupants of the Qo -site
of the bc1 Complex, probed by Electron
Spin Echo Envelope Modulation. Journ. Biol. Chem.2002, V. 277, p.
4605-4608.
4. A.R. Crofts,V.P. Shinkarev, S.A. Dikanov, R.I. Samoilova,
D.R.J. Kolling.
Interactions of quinone with iron-sulfur protein
of the bc1 complex: Is the mechanism spring-loaded? BBA 2002,
V.1555, p.48-53.
5. S.A. Dikanov, A.A. Shubin. Asako Kounosu, Toshio Iwasaki,
R.I.
Samoilova.
A comparative, two-dimensional
14N ESEEM
characterization of reduced [2Fe-2S] cluster in hyperthermophilic archaeal
high- and low-potential Rieske-type proteins. J. Biol. Inorg. Chem. 2004,
V.9, p.753-767.
6. Toshio Iwasaki, Asako Kounosu, R.I. Samoilova, S.A. Dikanov.
Orientation-selected 15N HYSCORE detection
of weakly coupled nitrogens around the archaeal Rieske [2F-2S] center.
JACS
2004, V. 126, p. 13902-13903.
![]() от карбонильной С-О группы хинона. Этому подвижному лиганду отводится важная
динамическая роль в переносе протона в этом месте. Используя дейтерозамещение,
удалось выявить три обменивающихся группы протонов вблизи радикала убихинона,
стабилизированного в Qi центре, отличающихся величиной изотропной
и анизотропной частей константы СТВ. Величины констант свидетельствуют
о принадлежности их водородно связанным протонам из ближайшего протеинового
окружения. В отличие от водородных связей, анализированных ранее в модельных
экспериментах, для радикала, стабилизированного в замороженных растворах,
протеиновые водородные связи значительно выходят из плоскости ароматического
кольца молекулы убихинона. Используя имеющиеся кристаллографические данные,
две группы протонов отнесены к боковым цепям His-217 и Asp-252 а третья,
с маленькой величиной константы СТВ, обусловлена водородной связью кислорода
метокси-групп с водой или близлежащим Asn-221. Эта сетка из водородных
связей удерживает радикал убихинона в соотвтствующей ориентации для эффективного
переноса электрона и протона. На основе этих данных была предложена механистическая
модель Qi центра.
от карбонильной С-О группы хинона. Этому подвижному лиганду отводится важная
динамическая роль в переносе протона в этом месте. Используя дейтерозамещение,
удалось выявить три обменивающихся группы протонов вблизи радикала убихинона,
стабилизированного в Qi центре, отличающихся величиной изотропной
и анизотропной частей константы СТВ. Величины констант свидетельствуют
о принадлежности их водородно связанным протонам из ближайшего протеинового
окружения. В отличие от водородных связей, анализированных ранее в модельных
экспериментах, для радикала, стабилизированного в замороженных растворах,
протеиновые водородные связи значительно выходят из плоскости ароматического
кольца молекулы убихинона. Используя имеющиеся кристаллографические данные,
две группы протонов отнесены к боковым цепям His-217 и Asp-252 а третья,
с маленькой величиной константы СТВ, обусловлена водородной связью кислорода
метокси-групп с водой или близлежащим Asn-221. Эта сетка из водородных
связей удерживает радикал убихинона в соотвтствующей ориентации для эффективного
переноса электрона и протона. На основе этих данных была предложена механистическая
модель Qi центра.