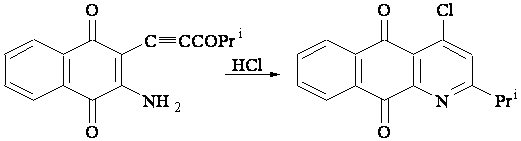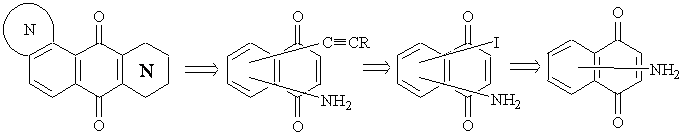Гетероциклические соединения занимают одно из центральных мест в органической химии. Изучение этих соединений стимулируется и остается неизменно актуальным благодаря, прежде всего их колоcсальному значению для фармации. Множество природных и синтетических биоактивных веществ имеет в своей структуре полициклическое ядро, включающее пиррольное или пиридиновое кольцо, не редко в сочетании с хинонным. Задача работы состояла в разработке методов синтеза подобных индол- и хинолиндионовых структур.
Нами использован общий подход к построению гетероциклов, заключающийся в аннелировании (достраивании) конденсированной ароматической системы гетероциклом с применением в качестве ключевых интермедиатов ее виц-функциональных ацетиленовых производных. Базисным соединением служил нафтохинон, аннелирование которого возможно как по бензольному, так и хинонному кольцам (схема 1).
Схема 1
Нами изучено 2 способа достраивания нафтохинона по бензольному кольцу пиррольным циклом. Установленно, что гетероциклизация 5-амино-6-алкинилнафтохинонов протекает, подобно индолизации антрахинона, в присутствии солей CuI в жестких условиях. Гетероциклизация другим способом происходит в отсутствие Cu-катализатора и, что существенно, в значительно более мягких условиях. Этот способ включает региоселективное присоединение втор.-амина по тройной связи и циклизацию аддуктов на адсорбенте с элиминированием амина (схема 2).Разработан способ 5,6-аннелирования пиридиновым циклом, заключающийся в присоединении втор.-аминов к виц-амино(кетоацетиленовым) предшественникам и внутримолекулярной циклизации аддуктов в присутствии HCl-кислоты (схема 2).
Схема 2
Наибольшие трудности вызывала разработка метода аннелирования пиридиновым циклом хинонного кольца. Метод образования 4-диалкиламинопиридинового цикла оказался для этого непригоден. Кроме того, этот метод имеет принципиальный недостаток: диалкиламинозаместитель в пиридиновом кольце практически невозможно заменить другими функциональными группами. В связи с этим нами разработан новый общий метод построения 4-галогенхинолиновой структуры. Метод представляет тандем реакций регио- и стереоселективного гидрогалогенирования и гетероциклизации виц-амино(3-оксоалкинил)аренов. Этим методом успешно получен целевой 4-хлорзамещенный азаантрахинон (схема 3).
Схема 3
Общность метода продемонстрирована также синтезом 4-бромхинолина и ряда линейно и ангулярно конденсированных тетрациклических соединений. Атом галогена в полученных соединениях отличается высокой подвижностью и легко замещается различными углеводородными и гетероатомными группами.
Разработка методов построения индольных и хинолиновых структур с необходимостью должна быть дополнена развитием способов получения ключевых предшественников из достаточно доступных исходных веществ. Ниже представлена обобщенная ретро-синтетическая схема получения ключевых ацетиленовых соединений (схема 4).
Схема 4
В соответствии с этой схемой нами предложен и реализован эффективный способ введения атомов иода в бензольное кольцо нафтохинона.
Для ацетиленовой конденсации нафтохинона, имеющего атом иода в бензольном кольце применена модифицированная нами и удобная методика реакции Соногаширы (водный диоксан, Na2CO3, вместо Et3N, сокращение времени реакции). Разработан впервые способ кросс-сочетания 2(3)-галогенхинонов с терминальными ацетиленами.
Таким образом, нами разработаны способы аннелирования нафтохинона пиридиновым и пиррольным гетероциклами; разработан новый общий метод синтеза 4-хлор(бром)хинолинов, хинолиновых и хинолиндионовых фрагментов полициклических соединений; развиты методы получения промежуточных продуктов и осуществлен рациональный синтез N-гетероциклических конденсированных хинонов из доступных исходных веществ.
Разработаные синтетические методы расширяют возможности получения новых или ранее трудноступных гетероциклических соединений с практически полезными свойствами. В работе это иллюстрировано синтезом 2-фенил-11-феноксинафт[2,3-f]индол-5,10-диона и 2-изопропил-4,12-дифеноксинафто[2,3-g]хинолин-6,11-диона – гетероциклических аналогов известного фотохрома – 6-фенокси-5,12-нафтаценхинона. При облучении УФ и видимым светом эти соединения подвергаются обратимой арилотропной перегруппировке (схема 5).
Схема 5
Фотоинициированная ана-форма феноксинафтиндолдиона отличается, что важно, относительной устойчивостью и выделена в кристаллическом виде. Для этого соединения определено соотношение пара- и ана-формы в условиях фотостационарного равновесия. Измерены квантовые выходы обеих фотохимических стадий. Оценена относительная стабильность ана-форм нового фотохрома и феноксинафтаценхинона.
Еще одно применение описанных методов – синтез аналогов алкалоида клейстофолина и природного антибиотика сампангина, обладающего уникальным фунгицидным действием. Синтезированы аминоаналоги клейстофолина. Работа в указанном направлении продолжается.
Вклад авторского коллектива.
Е.А. Колодина – синтез и разработка методов, М.С. Шварцберг – общее руководство, Н.П. Грицан – руководство фотохимическими исследованиями, Н.И. Лебедева - синтез, А.А. Мороз – участие в планировании и анализе результатов, И.Д. Иванчикова - синтез, Н.В. Ивашкина - синтез, В.С. Романов - синтез.
Список прилагаемых статей.
- Е.А. Яковлева, И.Д. Иванчикова, М.С. Шварцберг. Синтез замещенных бенз[g]индол-6,9-дионов и бензо[h]хинолин-7,10-дионов гетероциклизацией ацетиленовых производных 1,4-нафтохинона // Изв. АН, Сер. хим., 2005, 412-418
- И.В. Ивашкина, Е.А. Яковлева, И.Д. Иванчикова, А.А. Мороз, М.С. Шварцберг. Иодпроизводные 1,4-нафтохиноны// Изв. АН, Сер. хим., 2005, 1465-1469
- В. С. Романов, И. Д. Иванчикова, А. А. Мороз, М. С. Шварцберг.Замещение галогена на ацетиленовые группы в хиноидном цикле // Изв. АН, Сер. хим., 2005, 1636.
- M.S. Shvartsberg, E.A. Kolodina. Замещение галогена на ацетиленовые группы в хиноидном цикле// Mendeleev Commun., 2008, 18, 109-111.
- Е.А. Колодина, М.С. Шварцберг.Синтез бензо[g]хинолин-5,10-дионов // Изв. АН, Сер. хим., 2007, 2381-2385.
- E.A. Kolodina, M.S. Shvartsberg, N.P. Gritsan. Synthesis and photochromic properties of 11-phenoxy-2-phenylnaphth[2,3-f]indole-5,10-dione// Mendeleev Commun., 2008, 18, 302-304.