| |
Конкурс научных работ 2016 года
Взаимное влияние хиральных центров
на процессы с переносом заряда в диадах,
содержащих (S)- и (R)-напроксен.
Изучение методами спиновой химии
и флуоресцентной спектроскопии
Khramtsova E. A., Ageeva A. A., Nuin E.*, Marin M. L.*, Sosnovsky D. V.#,
Purtov P. A., Borisevich S. S.’, Khursan S. L.’, Roth H. D.”, I. M. Magin,
N. E. Polyakov, A. I. Kruppa, A. А.Stepanov, A. S. Kiryutin#,
Miranda M. A.*, Plyusnin V. F., Leshina T. V.
*Departamento de Quı ´mica/Instituto de Tecnologı ´a Quı ´mica UPV-CSIC,
Universitat Polite `cnica de Vale `ncia, Camino de Vera s/n, 46022 Valencia, Spain
#Международный Томографический центр СО РАН,
630090, г. Новосибирск, ул. Институтская, 3А
‘Уфимский Институт химии РАН, 450054, г. Уфа, проспект Октября, 71.
“Dept. Chem. & Chem. Biol., Rutgers State University, Piscataway, NJ 08854, USA
Установление причин различной активности хиральных лекарств является весьма актуальной проблемой, поскольку из т.н. «малых молекул» лекарств около 60 % имеют хиральные центры. При этом в большинстве случаев оптические изомеры существенно отличаются по лечебным свойствам. В этой области проводятся интенсивные биохимические и медицинские исследования, однако физико-химическая природа этих различий остается до конца неустановленной. Следует отметить, что этот вопрос представляет собой часть более глобальной проблемы – разгадки природы добиологического происхождения энантиомеров, т.е. причин первичного спонтанного хирального обогащения. Несмотря на сложность этой проблемы, относительно различия в свойствах хиральных лекарств, похоже, можно предложить вполне рациональное объяснение, связанное с тем, что в активных сайтах ферментов и рецепторов молекула лекарства, как правило, взаимодействует с другой оптически активной молекулой – аминокислотой. Таким образом, это уже взаимодействие двух хиральных центров, которое зачастую является донорно-акцепторным. Считается, что для моделирования таких взаимодействий можно использовать т.н. связанные системы – диады, содержащие оптические изомеры лекарств и аминокислоты или другие доноры электрона. Таким образом, эти системы представляют собой диастереомеры, которые уже отличаются по многим характеристикам, подобно энантиомерам в хиральных растворителях, и могут отличаться по реакционной способности. В представленном цикле работ исследуются фотоиндуцированные процессы с переносом заряда в донорно-акцепторных диадах, содержащих (S)-напроксен (нестероидный противовоспалительный препарат) и его (R)-аналог, связанные различными мостиками с хиральными донорами электрона: (S)-N-метилпирролидином и (L)-триптофаном. Применение фотоиндуцированных процессов для моделирования донорно-акцепторного взаимодействия в биологических системах является принятым приемом, и обусловлено следующими обстоятельствами. Использование фотогенерации позволяет значительно (в разы) увеличить концентрацию парамагнитных частиц, а, следовательно, дает возможность применять более широкий набор методов для их изучения. При этом предполагается, что реакционная способность парамагнитных интермедиатов, полученных в результате фотогенерации, в первом приближении не будет зависеть от способа их получения. Считается, что если активационный барьер в лиганд-рецепторном комплексе понижается за счет Ван-дер-Ваальсовых сил, образования комплекса с переносом заряда и/или водородных связей, то в фотоиндуцированном процессе это будет происходить за счет увеличения окислительного потенциала молекулы лекарства в возбужденном состоянии.
В работе изучались следующие диады:
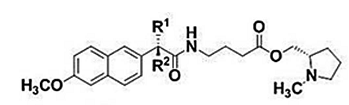 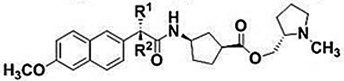
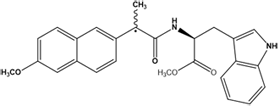
Выбор методов: спиновая химия (химически индуцированная поляризация ядер, ХПЯ) и флуоресцентная спектроскопия позволяют регистрировать все короткоживущие интермедиаты, образующиеся при тушении возбужденного состояния хромофора в исследуемых системах (см. схему). Так, из данных по ХПЯ в высоких магнитных полях получается информация об бирадикал цвиттер-ионе, образующемся в результате внутримолекулярного переноса электрона в исследуемых диадах [1,2]. Формы зависимостей эффективности ХПЯ от диэлектрической проницаемости среды в высоких и слабых магнитных полях [1-3] предоставляют косвенную информацию о присутствии или отсутствии эксиплекса, а данные флуоресцентной спектроскопии позволяют напрямую регистрировать более короткоживущие интермедиаты: локальное возбужденное состояние (ЛВ) и эксиплекс [1,2].
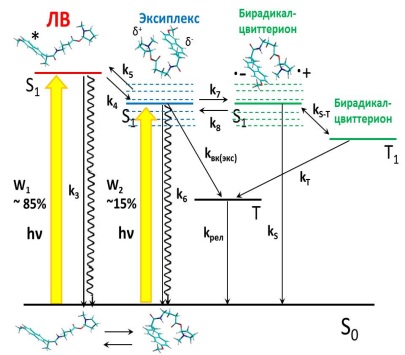
Схема изображает все фотоиндуцированные процессы в исследуемых системах на примере диад, содержащих напроксен и N-метилпирролидин. Анализ кинетических кривых тушения флуоресценции ЛВ и эксиплекса в средах различной полярности в рамках приведенной выше схемы, с помощью решения системы дифференциальных уравнений методом Рунге–Кутта, позволил оценить константы скоростей элементарных стадий процесса тушения возбуждения (S)- и (R)- оптических изомеров напроксена, находящихся в составе диастереомеров, донором электрона – N-метилпирролидином. При этом обнаружены различия в константах скоростей стадий, связанных с переносом заряда, и квантовых выходах флуоресценции ЛВ и эксиплекса для (S,S)- и (R,S)-диастереомеров диад (стереодифференциация). Анализ данных для всех диад, как изученных в данной работе, показал, что степень стереодифференциации зависит от длины и строения мостика, связывающего донор и акцептор, а также от полярности среды. Максимальный эффект (различие более чем в два раза для квантовых выходов флуоресценции эксиплексов для (R)- и (S)-изомеров) демонстрирует диада с самым коротким мостиком (не изображена). Самое большое различие в константах скоростей переноса электрона обнаружено в диастереомерах диады «(R/S)-напроксен-(S)-триптофан» в ацетонитриле: 8.3 ±0.1 108сек-1и 3.1±108сек-1. При этом сравнение активности (S)- и (R)- напроксена в модельных процессах в составе диад и в живых системах, где он взаимодействует с аминокислотами, показывает следующее. Во всех наших системах (R)-изомер более активен в процессах с переносом заряда. В живых системах он более эффективно подвергается микросомальному окислению под действием цитохрома Р450, которое также осуществляется через стадию одноэлектронного переноса. Более активен (R)-изомер и в таких процессах, как хиральная инверсия и ингибирование окисления других субстратов фермента ЦОГ-2, с которым взаимодействуют нестероидные противовоспалительные препараты. (S)-энантиомер, более склонный к обратимому связыванию с ферментом, в модельных системах показывает меньшие квантовые выходы люминесценции эксиплексов и большие квантовые выходы люминесценции ЛВ напроксена, что можно отнести к более слабому связыванию.
Список публикаций.
- Khramtsova E. A., Sosnovsky D. V., Ageeva A. A., Nuin E., Marin M. L., Purtov P. A., Borisevich S. S., Khursan S. L., Roth H. D., Miranda M. A., Plyusnin V. F., Leshina T. V. Impact of chirality on the photoinduced charge transfer in linked systems containing naproxen enantiomers // Physical Chemistry Chemical Physics. – 2016. – N. 18. – P. 12733-12741.
- E. Khramtsova, A. Ageeva,A. Stepanov, V. Plyusnin . Leshina, Photoinduced Electron Transfer in Dyads with (R)-/(S)-Naproxen and (S)-TryptophanZ //Phys. Chem. 2016, DOI 10.1515/zpch-2016-0842.
- I. M. Magin, N. E. Polyakov, A. I. Kruppa, P. A. Purtov, T. V. Leshina, A. S. Kiryutin, M. A. Miranda, E. Nuin, M. L. Marin, Low field photo-CIDNP in the intramolecular electron transfer in naproxen-pyrrolidine dyads// Phys. Chem. Chem. Phys. 18(2016) 901
|
| |